BRUKINSA® (zanubrutinib) est indiqué pour le traitement des patients adultes atteints de la macroglobulinémie de Waldenström (MW)1.
ÉTUDE COMPARATIVE DIRECTE DE BRUKINSA PAR RAPPORT À IBRUTINIB1
L’innocuité et l’efficacité de BRUKINSA ont été évaluées dans le cadre de l’étude ASPEN, une étude de phase III ouverte et multicentrique à répartition aléatoire comparant BRUKINSA et l’ibrutinib chez des patients atteints de la MW avec MYD88MUT n’ayant jamais reçu de traitement (JT) ou récidivant/réfractaire (R/R).
Méthodologie de l’étude ASPEN
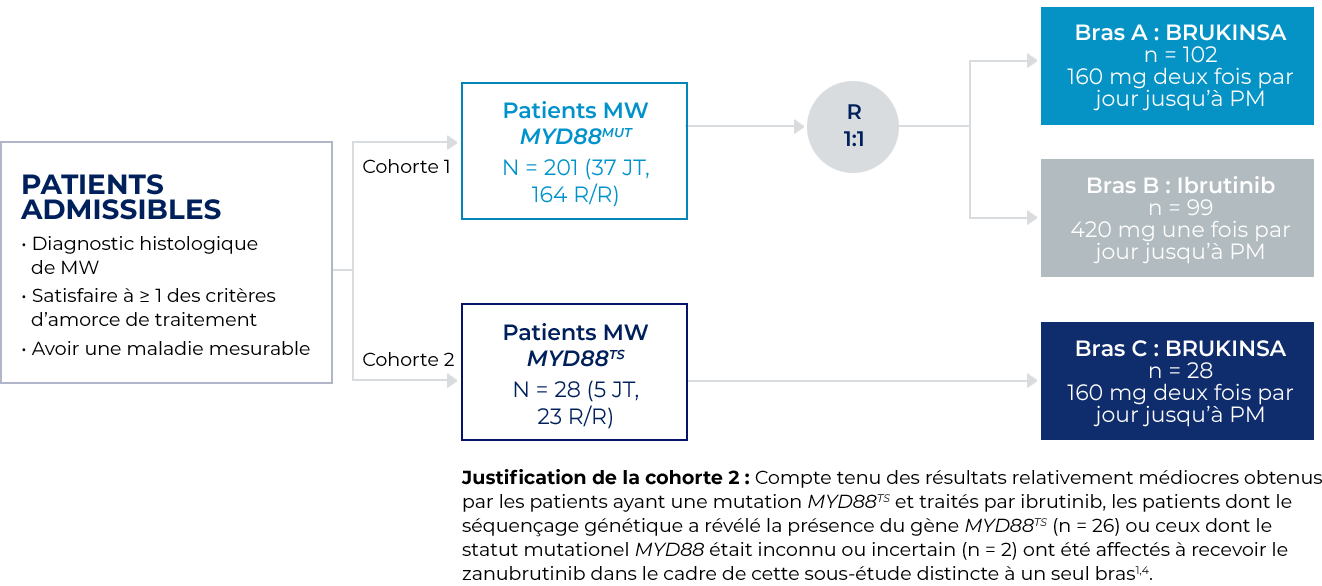
- Le critère d’évaluation principal était le taux de réponse complète (RC) ou de très bonne réponse partielle (TBRP) chez les patients atteints de la MW R/R avec mutation du gène MYD88MUT, selon l’évaluation du CEI.
ÉVALUÉ À L’ÉCHELLE MONDIALE CHEZ UN ÉVENTAIL DE PATIENTS
| Caractéristiques initiales des patients1 | Cohorte 1 MYD88MUT (n = 201) |
Cohorte 2 MYD88TS (n = 28) |
|---|---|---|
| Âge médian | 70 ans (plage : 38 à 90) |
72 ans (plage : 39 à 87) |
| > 75 ans | 28 % | 43 % |
| Homme | 67 % | 50 % |
| Race blanche | 91 % | 96 % |
| ECOG 0-1 2 |
94 % 6 % |
86 % 14 % |
| N’ayant jamais été traité (JT) | 18 % | 18 % |
| Récidivant/réfractaire (R/R) | 82 % | 82 % |
| Temps médian depuis le diagnostic | 4,6 ans | 3,7 ans |
| Nombre médian de thérapies antérieures | 1 (plage : 1 à 8) | 1 (plage : 1 à 5) |
- La disposition et les données démographiques des patients de la cohorte 1 étaient généralement similaires entre les groupes BRUKINSA et ibrutinib, sauf en termes de pourcentage des patients > 75 ans (22 % dans le groupe ibrutinib et 33 % dans le groupe BRUKINSA).
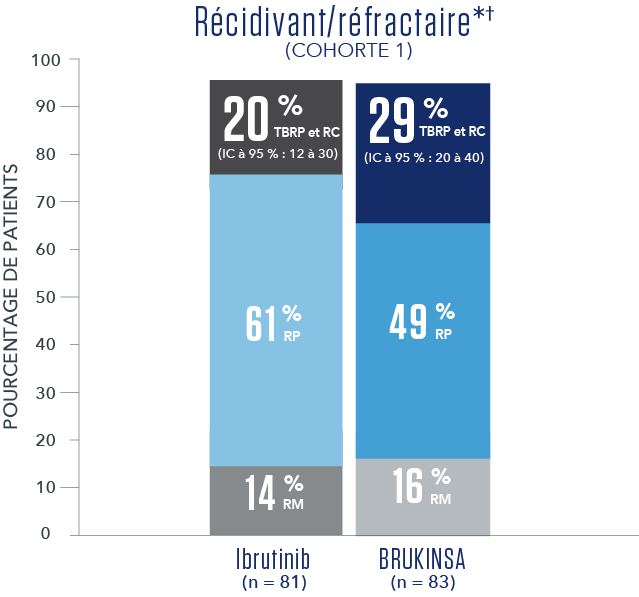
RÉSULTATS DE L’EFFICACITÉ SELON L’ÉVALUATION DU CEI1
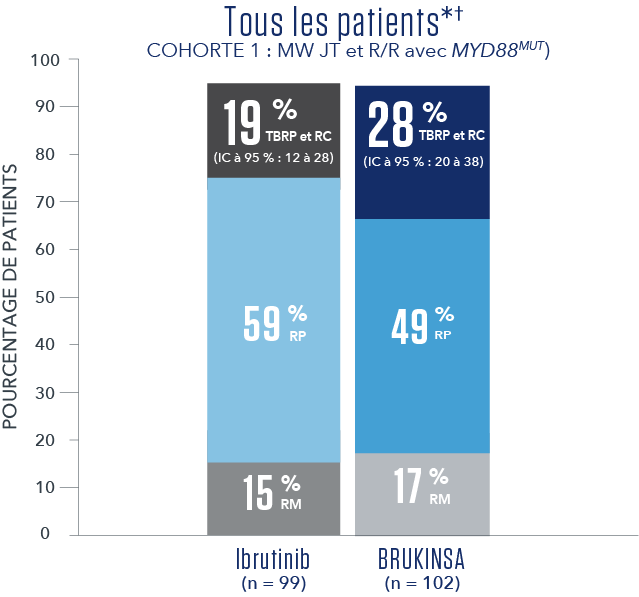
- * Aucune RC n’a été observée.
- † Le suivi médian global était de 19,4 mois5.
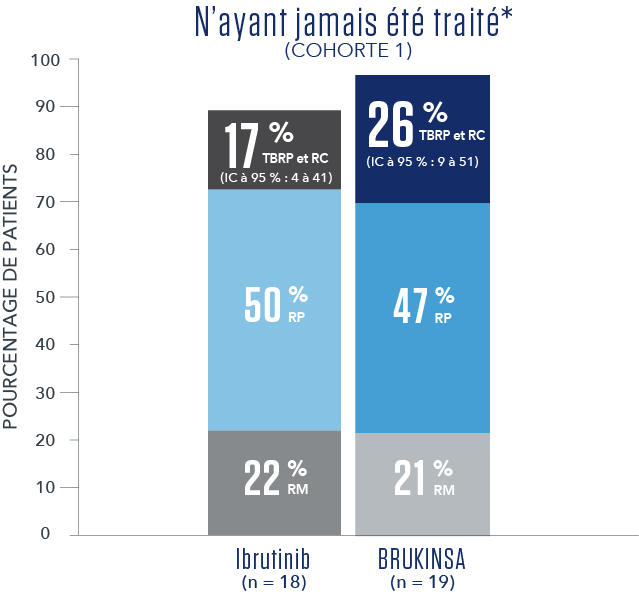
- * Aucune RC n’a été observée.
- * Aucune RC n’a été observé.
- † Le suivi médian des R/R était de 18,8 mois.
- Les résultats primaires de l'étude n'ont pas atteint la signification statistique pour l'ensemble de l’analyse des R/R (test bilatéral p = 0,12), et donc, l'étude n'a pas atteint le critère primaire d'efficacité.
COHORTE 2 : Taux de VGPR et de RC chez les patients atteints de MW avec MYD88 TS1*
N’ayant jamais été traité
(JT)
20
Récidivant/réfractaire
(R/R)
29
- * Aucune RC n’a été observée.
- CEI = comité d’examen indépendant; ECOG = Eastern Cooperative Oncology Group; PM = progression de la maladie; RM = réponse mineure; RP = réponse partielle; TBRP = très bonne réponse partielle.
ÉVÉNEMENTS INDÉSIRABLES (EI) CHEZ ≥ 10 % DES PATIENTS ATTEINTS DE LA MW DANS LA COHORTE 11
| Catégories d’organes ou de systèmes | Effets indésirables | BRUKINSA (N = 101) | Ibrutinib (N = 98) | ||
|---|---|---|---|---|---|
| Tous les grades (%) |
Grade 3 ou plus (%) |
Tous les grades (%) |
Grade 3 ou plus (%) |
||
| Troubles hématologiques et du système lymphatique | Neutropénie | 25 | 16 | 12 | 8 |
| Anémie | 12 | 5 | 10 | 5 | |
| Thrombocytopénie | 10 | 6 | 10 | 3 | |
| Troubles cardiaques | Fibrillation auriculaire | 2 | 0 | 14 | 3 |
| Troubles gastro-intestinaux | Diarrhée | 21 | 3 | 32 | 1 |
| Constipation | 16 | 0 | 7 | 0 | |
| Nausées | 15 | 0 | 13 | 1 | |
| Vomissements | 9 | 0 | 13 | 1 | |
| Troubles généraux et au site d’administration | Fatigue | 19 | 1 | 15 | 1 |
| Pyrexie | 13 | 2 | 12 | 2 | |
| Œdème périphérique | 9 | 0 | 19 | 0 | |
| Infections et infestations | Infection des voies respiratoires supérieures | 24 | 0 | 29 | 1 |
| Nasopharyngite | 11 | 0 | 7 | 0 | |
| Infection des voies urinaires | 10 | 0 | 10 | 2 | |
| Pneumonie | 9 | 3 | 20 | 7 | |
| Troubles musculo-squelettiques et du tissu conjonctif | Douleur musculosquelettique | 30 | 7 | 24 | 0 |
| Douleur aux extrémités | 11 | 1 | 7 | 0 | |
| Spasmes musculaires | 10 | 0 | 24 | 1 | |
| Troubles du système nerveux | Céphalées | 15 | 1 | 11 | 1 |
| Étourdissements | 13 | 0 | 9 | 0 | |
| Troubles rénaux et urinaires | Hématurie | 7 | 0 | 10 | 2 |
| Troubles respiratoires, thoraciques et médiastinaux | Dyspnée | 14 | 0 | 6 | 0 |
| Toux | 13 | 0 | 17 | 0 | |
| Épistaxis | 13 | 0 | 19 | 0 | |
| Troubles de la peau et du tissu sous-cutané | Éruption cutanée | 18 | 0 | 21 | 0 |
| Ecchymoses | 18 | 0 | 34 | 0 | |
| Troubles vasculaires | Hémorragie | 21 | 5 | 24 | 4 |
| Hypertension | 11 | 6 | 16 | 11 | |
Le profil d’innocuité de la cohorte 2 (patients avec MYD88TS) était généralement cohérent avec celui de la cohorte 1.
COHORTE 1 : Taux de diminution de la posologie et d’arrêt de traitement avec BRUKINSA (N = 101)1
Taux d’arrêt de traitement
en raison d’EI*
4
Diminution de la posologie
en raison d’EI†
14
- *Les événements menant à l’arrêt du traitement ont été la cardiomégalie, la neutropénie, le myélome à plasmocytes et l’hémorragie sous-durale (1 % chacun).
- †Les effets indésirables les plus fréquents ayant mené à une baisse de la posologie étaient la neutropénie (3 %) et la diarrhée (2 %).
POSOLOGIE
POSOLOGIE UNE FOIS OU DEUX FOIS PAR JOUR1
Le seul inhibiteur de la BTK pouvant être administré soit UNE FOIS ou DEUX FOIS par jour1

Administration1
- Peut être pris avec ou sans aliments. Peut être pris avec un repas riche en matières grasses – la concentration (ASC) BRUKINSA (ASC) n’est pas touchée.
- Aviser les patients d’avaler les capsules entières avec de l’eau; ne pas ouvrir, dissoudre ou mâcher les capsules
- BRUKINSA ne doit pas être pris avec du jus de pamplemousse, des pamplemousses, et/ou des oranges de Séville
- Si une dose de BRUKINSA est oubliée, elle doit être prise dès que possible, avec une reprise de l’horaire habituel le lendemain
BRUKINSA doit être administré jusqu’à la progression de la maladie ou l’apparition d’une toxicité inacceptable.
- ASC = aire sous la courbe
AJUSTEMENTS POSOLOGIQUES RECOMMANDÉS1
| CYP | Médicament concomitant | Posologie recommandée |
|---|---|---|
| Inhibition | Inhibiteur puissant du CYP3A (p. ex. posaconazole, voriconazole, kétoconazole, itraconazole, clarithromycine, lopinavir, ritonavir, télaprévir) | 80 mg une fois par jour Interrompre l’administration comme recommandé en cas d’effets indésirables |
| Inhibiteur modéré du CYP3A (p. ex. érythromycine, ciprofloxacine, diltiazem, dronédarone, fluconazole, vérapamil, aprépitant) | 80 mg deux fois par jour Modifier la dose comme recommandé en cas d’effets indésirables |
|
| Induction | Inducteur puissant du CYP3A (p. ex. carbamazépine, phénytoïne, rifampicine) | Éviter une utilisation concomitante; envisager l’utilisation d’autres agents entraînant une induction moindre du CYP3A. |
| Inducteur modéré du CYP3A (p. ex. bosentan, éfavirenz, étravirine, modafinil, nafcilline) | Éviter une utilisation concomitante. Si une utilisation concomitante ne peut être évitée, augmenter la dose de BRUKINSA à 320 mg deux fois par jour. Surveiller étroitement les toxicités. |
Aucun ajustement posologique n’est recommandé chez les patients atteints d’une insuffisance rénale ou hépatique, légère à modérée.
Modification POSOLOGIQUE POUR LES EFFETS INDÉSIRABLES (EI) DE GRADE 3 OU PLUS1
Ajustements posologiques recommandés en cas d’EI de grade 3 ou plus
- Grade ou plus : effets toxiques non hématologiques
- Grade 3: neutropénie fébrile/thrombocytopénie accompagnée d’une hémorragie importante
- Grade 4: neutropénie*/thrombocytopénie*
| Dose de départ | 1er épisode | 2e épisode | 3e épisode | 4e épisode |
|---|---|---|---|---|
| Débuter à 320 mg† dose totale |
Interrompre BRUKINSA | Interrompre BRUKINSA | Interrompre BRUKINSA | Mettre fin au traitement |
| Reprendre BRUKINSA lorsque la toxicité s’est atténuée jusqu’à un grade 1 ou revenue à l’intensité de départ | Reprendre BRUKINSA lorsque la toxicité s’est atténuée jusqu’à un grade 1 ou revenue à l’intensité de départ | Reprendre BRUKINSA lorsque la toxicité s’est atténuée jusqu’à un grade 1 ou revenue à l’intensité de départ | ||
| Aucune réduction de dose. 320 mg† dose totale |
Réduire à 160 mg dose totale |
Réduire à 80 mg dose totale |
- * Durant plus de 10 jours consécutifs.
- † 160 mg deux fois par jour ou 320 mg une fois par jour.
- EI = effets indésirables
Effets indésirables groupés survenant sous traitement chez ≥ 10 % des patients attteints d’hémopathies malignes* (N = 1 550)6
| Effets indésirables survenant sous traitement | BRUKINSA (N = 1 550) | |
|---|---|---|
| Tous les grades (%) | Grade 3 ou plus (%) | |
| Infections des voies respiratoires supérieures† | 37,1 | 2,2 |
| Ecchymoses† | 30,4 | 0,5 |
| Neutropénie† | 27,5 | 18,5 |
| Hémorragie/ hématome† | 27,4 | 3,0 |
| Douleur musculosquelettique† | 27,0 | 1,8 |
| Éruptions cutanées† | 25,0 | 0,7 |
| Diarrhée | 18,8 | 1,5 |
| Toux† | 18,6 | 0,1 |
| Pneumonie† | 17,9 | 9,4 |
| Fatigue† | 16,2 | 1,2 |
| Thrombocytopénie† | 15,9 | 5,7 |
| Anémie† | 14,1 | 5,2 |
| Hypertension† | 13,0 | 6,5 |
| Constipation | 12,3 | 0,3 |
| Infection des voies urinaires† | 11,6 | 1,7 |
| Étourdissements† | 10,7 | 0,3 |
- * Leucémie lymphoïde chronique, lymphome à petits lymphocytes, macroglobulinémie de Waldenström, lymphome à cellules du manteau, lymphome folliculaire, lymphome de la zone marginale, leucémie à tricoleucocytes, lymphome diffus à grandes cellules B et transformation de Richter.
- † Indique un terme groupé qui comprend de multiples termes privilégiés.
Effets indésirables d’intérêt sélectionnés et groupés survenant sous traitement chez des patients atteints d’hémopathies malignes* (N = 1 550)6
| Effets indésirables survenant sous traitement | Tous les grades (%) | Grade 3 ou plus (%) |
|---|---|---|
| Arthralgie | 12,8 | 0,3 |
| Myalgie | 3,9 | 0,3 |
| Fibrillation auriculaire | 2,9 | 0,8 |
| Flutter auriculaire | 0,3 | 0,0 |
Des 1 550 patients traités avec BRUKINSA, 3 % ont arrêté le traitement et 5,2 % ont subi des diminutions de la posologie en raison d’effets indésirables1.
RENSEIGNEMENTS RELATIFS À LA COMMANDE DE BRUKINSA
BRUKINSA est disponible dans toutes les pharmacies du Canada. Si vous êtes une pharmacie cherchant à acheter BRUKINSA, il est disponible auprès des grossistes suivants :
Bureau des commandes Sentrex :
Courriel : orders@sentrex.com
Télécopieur : 1-833-736-8739
Téléphone : 1-888-207-4618, du lundi au vendredi (de 8 h à 20 h HE).
Bureau des commandes Innomar :
Courriel : specialtylogistics@innomar-strategies.com
Téléphone : 1-866-949-9927, du lundi au vendredi (de 8 h à 20 h HE).
PROGRAMME DE SOUTIEN AUX PATIENTS 
Conçu pour fournir des renseignements et de l’aide appropriés aux patients BRUKINSA, notamment :
Aide au remboursement/paiement
- Des gestionnaires de cas dédiés qui aident à la vérification de l’assurance, de l’accès temporaire en attente du remboursement ou de l’aide à la coassurance, afin que les patients puissent avoir accès à BRUKINSA
Éducation et soutien
- Des infirmières gestionnaires de cas dédiées aux patients, aux proches aidants et aux professionnels de la santé
- Qui aident à fournir des renseignements sur la maladie et le traitement par BRUKINSA
- Des pharmaciens de spécialité qui discutent avec les patients à chaque renouvellement d'ordonnance
Liens avec des organismes de défense des droits tiers
- Aide les patients et les soignants de façon pratique grâce à des liens avec des groupes de défense des droits et des ressources libres locales/nationales, comme:
- De l’éducation et des événements
- Renseignements sur les groupes de soutien
LE PROGRAMME D’ÉCHANTILLON DE BEIGENE
BeiGene vous fournit des échantillons de BRUKINSA (zanubrutinib) pour vos patients

RECEVEZ UN ÉCHANTILLON EN 2 ÉTAPES FACILES
- Cliquez ci-dessous sur « Demande d’échantillon » ou demandez un formulaire de demande d’échantillon à votre gestionnaire régional de BeiGene.
- Remplissez le formulaire et soumettez.


Ce sont des échantillons de médicaments sur ordonnance fournis conformément au Règlement sur les aliments et drogues. Il est illégal de vendre, de faire le commerce, d’échanger, de retourner pour un crédit, d’utiliser pour demander un remboursement ou de facturer les échantillons à vos patients.


